台灣女人連線與立法委員林淑芬辦公室今日(23日)召開記者會,呼籲政府對乳房植入物要有更積極的掌握與管理,以照護女性健康。
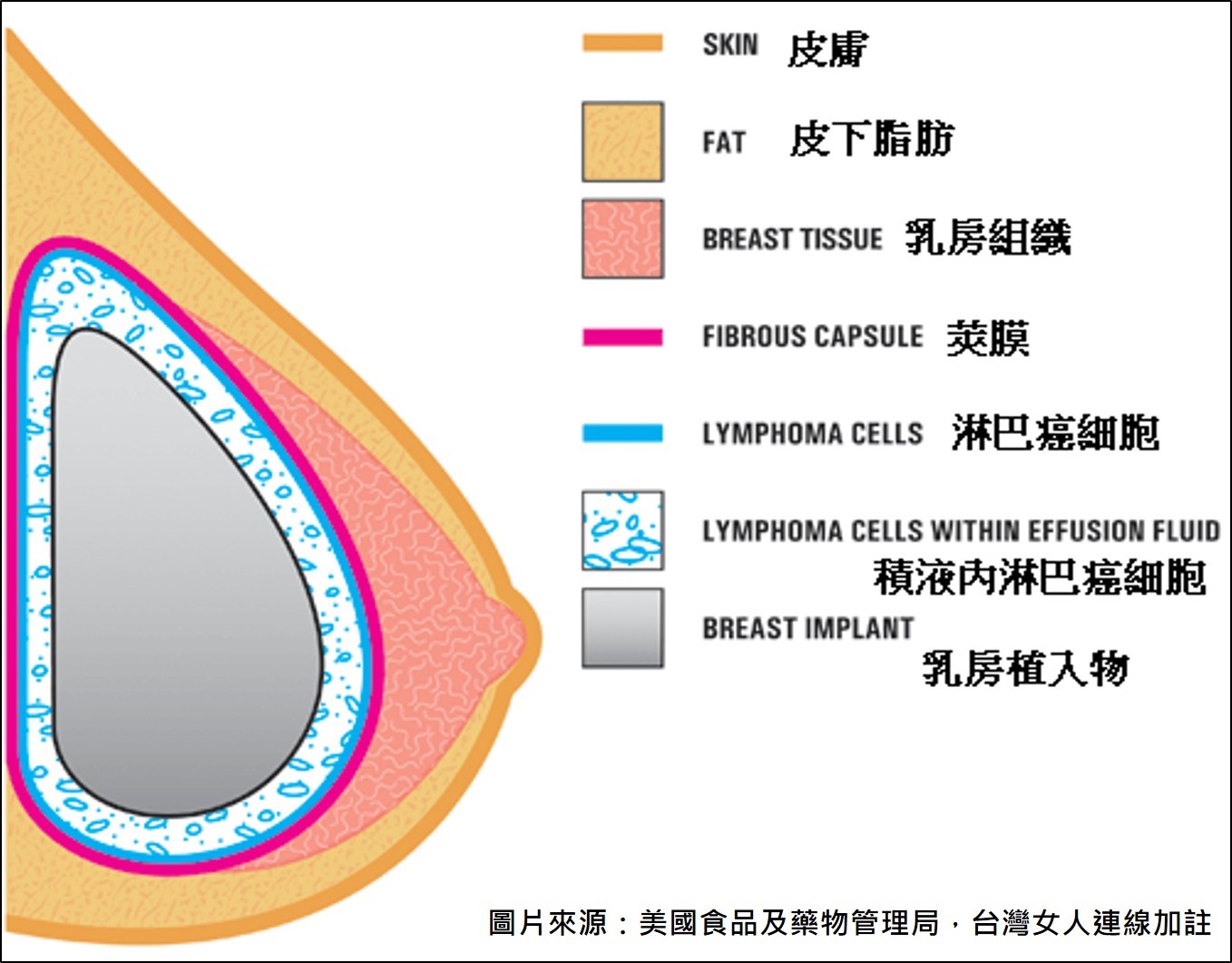
間變性大細胞淋巴癌(ALCL)是一種罕見的T細胞淋巴癌,可能出現在身體的許多部位。美國FDA在2011年指出有些ALCL的發生和乳房植入物可能有關聯,稱之為BIA-ALCL(Breast Implant-Associated Anaplastic Large Cell Lymphoma),這是屬於免疫系統的癌症,不是乳癌。由於病例數不斷增加,美、英、澳、加等國皆對國內進行調查,瞭解罹病情形,並持續進行監控。法國去年12月拒絕展延某品牌絨毛型植入物的安全許可,今年2月召開公聽會,與會專家呼籲禁用此品牌絨毛型植入物。在台灣,此廠牌絨毛型矽膠乳房植入物經食藥署核准上市,許多女性正在使用,但因手術同意書無相關說明,民眾對罹患淋巴癌的風險毫無所悉,可能危害女性健康。
台灣女人連線常務理事黃淑英表示,相較各國積極作為,食藥署僅在2011年與2016年發公文給包括整形外科醫學會、台灣美容醫學會等,要求醫師進行評估、告知與觀察,2017年發布產品安全警訊,至今沒有積極研議對使用情形進行調查與了解,這讓國內對於乳房植入物與癌症的關聯性無從了解。而台灣105年共有393人確診ALCL,但因不知是否有使用乳房植入物,無法初步瞭解其中相關性。
林淑芬委員說,國家核准乳房植入物進到國內,並植入民眾身體裡,國家就應對風險管理負起責任。相較於各國積極的態度,台灣主管機關並無積極作為,讓女性陷於健康風險之中。
台灣女人連線與立委林淑芬要求,政府應建立全國乳房植入手術登錄制度,以監測植入物與ALCL及其他健康問題的關聯;將BIA-ALCL的相關風險說明,加入乳房整形/手術重建說明書;此外也應加強醫療人員及使用者對BIA-ALCL的認識及保持對疾病的敏感度。
衛福部醫事司簡任技正劉越萍回應,衛福部會將風險訊息加入乳房整形手術同意書中,預計三月中公告。
衛福部食藥署醫粧組副組長王淑芬表示,乳房植入物使屬於風險較高的醫療器材,上市前都有審查。對於上市後的把關,食藥署有提出《醫療器材管理法》修法,要求廠商及醫療診所對醫療器材的流向及病人使用做記錄,但法案還在立法院未完成二、三讀。然而面對林淑芬委員追問目前究竟如何掌握與管理風險,食藥署也無法有確切的回答。
BIA-ALCL示意圖